Comment fonctionne un récepteur de neurotransmetteur au niveau atomique ?
Depuis de nombreuses années, les chercheurs du CNRS et de l'Institut Pasteur s’attardent à comprendre les mécanismes intervenant dans la communication entre les neurones du cerveau. Grâce à un système bactérien mimant le récepteur humain de la nicotine, ils ont réussi à simuler, au niveau atomique, les changements conformationnels intervenant dans la traduction du signal chimique apporté par le neurotransmetteur en un signal électrique, dans le neurone. Ces travaux ont donné lieu à une publication dans la revue PNAS le 22 mars 2010 et ouvrent la voie à la mise en place future de médicaments adaptés aux pathologies cérébrales comme le tabagisme.
Dans le cerveau, la communication entre neurones fait intervenir des substances chimiques, telles que l’acétylcholine ou la dopamine : les neurotransmetteurs. Ces derniers ont pour cibles des récepteurs (protéines de la membrane du neurone) qui transforment le signal chimique reçu en un signal électrique. Les scientifiques et cliniciens s’intéressent particulièrement à ces récepteurs car ils sont souvent la cible de drogues puissantes, comme la nicotine. Comment les récepteurs convertissent-ils la liaison du neurotransmetteur en signal électrique ? En fait, la molécule chimique change de conformation et contrôle ainsi l’ouverture ou la fermeture d’un canal ionique au travers duquel passent des ions sodium et des ions potassium qui créent un courant électrique.
Des chercheurs du CNRS et de l’Institut Pasteur viennent tout juste d’élucider une nouvelle étape clé de ce mécanisme. Pour cela, ils ont utilisé un récepteur bactérien proche du récepteur humain de la nicotine qui possède l’avantage exceptionnel de donner accès, par des méthodes cristallographiques, à l’organisation de la molécule neurotransmetrice au niveau atomique. A l’aide d’ordinateurs extrêmement puissants (1), ils sont parvenus à simuler, pour la première fois et pendant une microseconde, le mouvement des 200 000 atomes qui composent le modèle de la molécule et à suivre ce qui pourrait être un moment critique de la transition conformationnelle contrôlant le degré d’ouverture du canal ionique. Ces travaux sont d’une importance cruciale dans la compréhension des processus atomiques complexes qui gouvernent les changements conformationnels, ou transitions allostériques, des récepteurs neuronaux.
Trois groupes de chercheurs ont contribué à ce travail mêlant méthodes expérimentales et simulations numériques : l’équipe de Marc Baaden au Laboratoire de Biochimie Théorique (UPR9080 CNRS, Paris), et deux équipes de l’Institut Pasteur ; le groupe Dynamique structurale des macromolécules (URA2185 CNRS/Pasteur, Paris) dirigé par Marc Delarue, directeur de recherche au CNRS, et le groupe à 5 ans Récepteurs canaux (URA2182 CNRS/Pasteur, Paris) dirigé par Pierre-Jean Corringer, également directeur de recherche au CNRS.
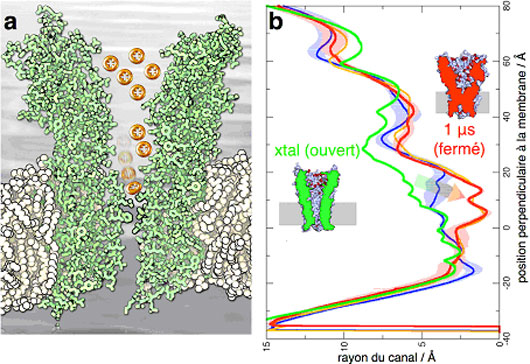
Le système bactérien étudié n’est pas directement sensible à un neurotransmetteur mais à un changement de pH. La structure atomique du récepteur est initialement dans une conformation ouverte à pH acide. La fermeture du canal ionique est déclenchée par un changement abrupt de conformation à pH neutre. Dans des fractions de temps de l’ordre du millionième de seconde, le canal se trouve rapidement bloqué par le changement de conformation d’une des sous-unités du récepteur qui initie ensuite le mouvement de sa voisine, qui lui-même se propage de proche en proche, à la manière de dominos.
Ces travaux permettent de mieux comprendre le mode d’action des neurotransmetteurs sur leurs récepteurs et ainsi d'avancer dans la conception rationnelle de médicaments actifs sur ces récepteurs par « modélisation moléculaire ». Il s'agit de découvrir de nouvelles molécules capables d’agir sur les transitions conformationnelles d'ouverture et de fermeture des récepteurs et donc de contrôler leur fonction, avec comme but d’agir sur des pathologies cérébrales telles que, dans le cas du récepteur nicotinique, le tabagisme, la maladie d’Alzheimer ou encore la schizophrénie.
Figure :Fermeture du récepteur GLIC à partir d'une simulation de 1 μs. A) Coupe de GLIC (vert) inséré dans une bicouche lipidique (blanc), avec des cations (rouge) s'accumulant dans deux réservoirs extracellulaires. Le canal est bloqué, ce qui est illustré par un ion rebondissant sur la zone de constriction hydrophobe. B) Rayon du pore central le long de l'axe du canal, pour la structure cristallographique de GLIC (ligne verte) et pour plusieurs parties de la simulation de dynamique moléculaire menant à la fermeture (ligne rouge). Les coupes des états ouvert et fermé sont indiquées dans la figure. © Marc Baaden
Notes :
- Ces travaux ont bénéficié d’un accès aux moyens de calcul de l’IDRIS au travers de l'allocation de ressources 2009-072292 attribuée par GENCI (Grand Equipement National de Calcul Intensif) à Marc Delarue.